
Neurobiología Molecular de la Memoria
Dra. Mariana Feld
DIRECTORA DE PROYECTO
Investigadora Adjunta CONICET
mfeld@fbmc.fcen.uba.ar
In our group, we study the involvement of mitogen-activated protein kinase (MAPK) pathways, particularly ERK1/2, in different phases of memory. To this end, we consider both physiological conditions and early stages of pathological processes, in which incipient dysregulation of normal physiology can be inferred.
To address these questions, we use two evolutionarily distant species: the crab Neohelice granulata and the mouse Mus musculus. In both models, we have established the role of these pathways as part of the molecular mechanisms that enable long-term memory formation. Additionally, we extend our studies to models of Alzheimer’s disease (AD), which is characterized in its early stages by cognitive decline and memory loss, allowing us to identify fundamental physiological mechanisms that underlie memory processes.
En nuestro grupo estudiamos la participación de las vías de proteínas quinasas activadas por mitógenos (MAPKs, por mitogen-activated protein kinases), particularmente ERK1/2, en distintas fases de la memoria. Para ello, consideramos tanto situaciones fisiológicas como estadios iniciales de procesos patológicos, en los que se puede inferir una desregulación incipiente de la fisiología.
Para abordar estas preguntas, utilizamos dos especies evolutivamente distantes: el cangrejo Neohelice granulata y el ratón Mus musculus. En ambos modelos, hemos establecido el papel de estas vías como parte de los mecanismos moleculares que permiten la formación de memorias a largo plazo. Además, extendemos nuestros estudios a modelos de la enfermedad de Alzheimer (EA), caracterizada en sus etapas iniciales por deterioro cognitivo y pérdida de memoria, lo que nos permite identificar mecanismos fisiológicos básicos que sustentan los procesos mnésicos.

Our studies show that ERK activation in the crab’s central brain is required one hour after a 15-trial training session, which induces the formation of a contextual memory lasting approximately five days. Inhibition of the ERK pathway produces impairment of long-term memory (LTM) without affecting short-term memory.
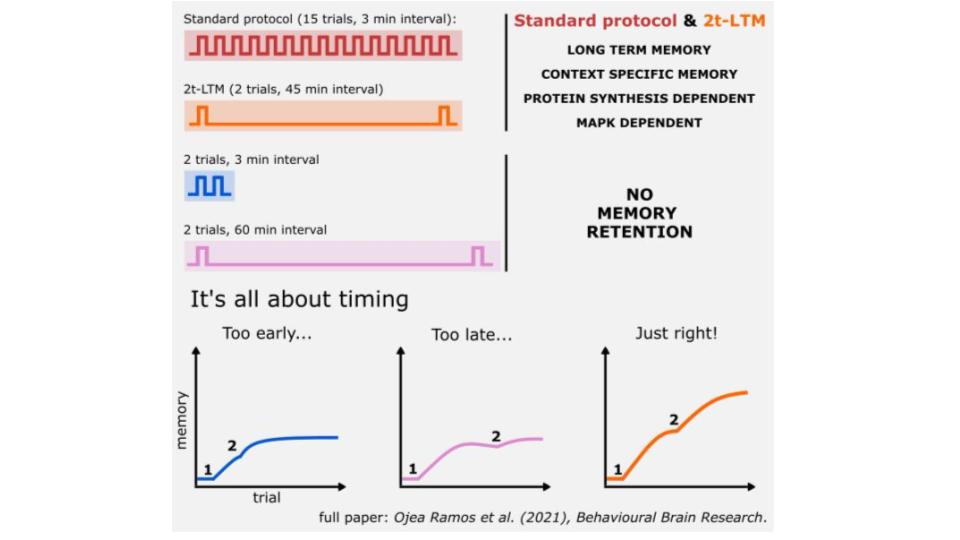
Recently, we developed a training protocol capable of inducing contextual memory formation with only two trials spaced 45 minutes apart (2t-LTM, see figure), allowing us to assess the individual contribution of each trial to memory stabilization. We observed that the first trial induces ERK pathway activation at 30 minutes, whereas the second triggers a faster phosphorylation response compared to the first one (at 5 minutes). Formation of the 2t-LTM depends on both activation events, as well as on the time interval between trials, enabling new hypotheses regarding the role of this pathway in LTM stabilization (see figure).
Memory and Aβ peptide in the crab:
Memory and βA peptide in the crab
The beta-amyloid (βA) peptide originates from the cleavage of the βA precursor protein (APP). The corresponding gene in the crab (cappl) shows 37% identity with its homolog in the fruit fly (Drosophila melanogaster) and 23% with that of Homo sapiens, although it exhibits a much higher degree of sequence similarity in specific regions. In addition, cAPPL mRNA and protein are widely distributed throughout the crab’s central nervous system, in both associative and sensory brain areas, and the temporal pattern of expression suggests a role for cAPPL during long-term memory (LTM) formation (Fustiñana et al., 2010).
Consistently, our studies showed that low doses of βA aggregates impair contextual memory formation in the crab, and that this effect is mediated, at least in part, by activation of the ERK/MAPK pathway, interfering with the encoding processes required for LTM consolidation (Feld et al., 2008). These findings suggest a fine regulation of the ERK/MAPK pathway, which appears to be disrupted by the administration of βA aggregates. However, further characterization of this effect, as well as the identification of the neural regions involved in these processes in Neohelice, is still needed.
In collaboration with Dr. Mariano M. Boccia (Laboratory of Neuropharmacology of Memory Processes, FFyB, UBA), we characterized three periods of ERK1/2 activation following the reactivation of a consolidated inhibitory avoidance memory. These activation phases distinguish strong from weak memories and are relevant to three distinct stages of the memory process (see Fig.). Pharmacological inhibition of this pathway in the dorsal hippocampus of mice interferes with restabilization (when applied immediately after reactivation; Krawczyk et al., 2015), strengthening (when applied 40 minutes later; Krawczyk et al., 2015), or persistence (when applied 180 minutes later; Krawczyk et al., 2016).
We recently showed that the scarcely explored mechanism of ERK dimerization provides an additional regulatory layer to the strengthening/disruption process that follows IA memory retrieval-induced labilization (Ojea Ramos et al., 2024).
Beta-amyloid peptide (βA) and memory
The beta-amyloid (βA) peptide is the main component of neuritic plaques found in post-mortem brain biopsies from patients with Alzheimer’s disease (AD). Clinically, AD is initially characterized by cognitive difficulties and progressive memory loss, which become increasingly severe and disabling in the advanced stages of the disease. In contrast to the extensive research devoted to the neurotoxicity and neurodegeneration caused by chronic peptide accumulation, relatively little attention has been given to the possible physiological role of βA.
In vitro, βA can bind with high affinity to nicotinic acetylcholine receptors (nAChRs) and induce the activation of several signaling pathways involved in memory formation, such as ERK/MAPK and NF-κB, among others. These effects depend on factors including the specific peptide used (e.g., βA₁₋₄₀ or βA₁₋₄₂), its concentration, the exposure type (chronic or acute), and its aggregation state. However, the relationship between the mnemonic effects of βA and alterations in these signaling pathways in in vivo memory paradigms has not yet been examined in detail.
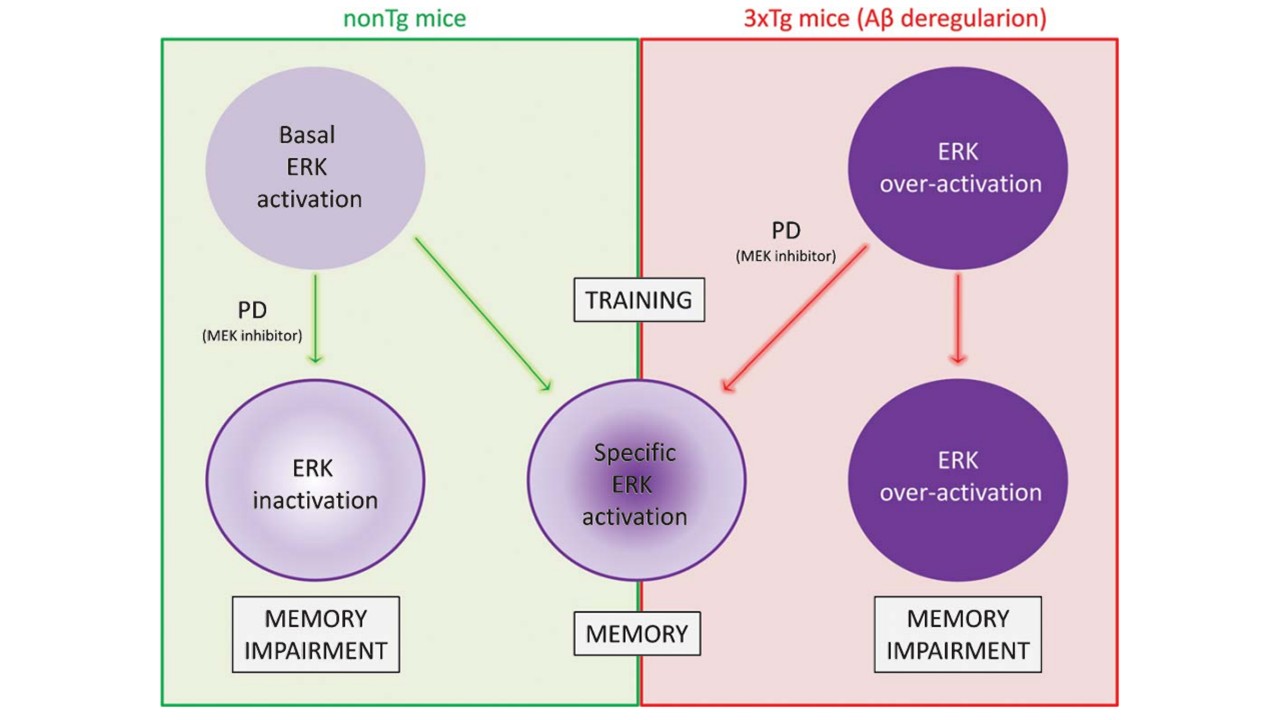
In this context, we investigated the molecular mechanisms underlying memory in murine models of AD that closely recapitulate the progression of the human pathology. In these studies, we characterized early memory impairments in the novel object recognition task, suggesting a subtle dysregulation of the physiological function of βA in the hippocampus and prefrontal cortex. Moreover, we observed increased ERK1/2 activation in the prefrontal cortex — in the cytosolic fraction at 3 months and in the nuclear fraction at 6 months — while no alterations were detected in other signaling pathways (e.g., JNK, NF-κB, and calcineurin). In this model, intra-PFC administration of a pathway inhibitor reversed the memory deficit, suggesting that the observed alterations may at least partially account for the impairment, likely as a consequence of interference with memory trace consolidation (Fig.).
 Currently, we are characterizing other behavioral domains in a similar model, but with a pure and genetically controlled background, to further elucidate the molecular and cellular bases underlying physiological memory processes that are altered in the early stages of neurodegenerative pathologies, specifically Alzheimer’s disease (AD).
Currently, we are characterizing other behavioral domains in a similar model, but with a pure and genetically controlled background, to further elucidate the molecular and cellular bases underlying physiological memory processes that are altered in the early stages of neurodegenerative pathologies, specifically Alzheimer’s disease (AD).
Recognition memory in mice
Recognition memory in mice depends on the identification and evaluation of prior and temporally close events, involving brain regions such as the medial prefrontal cortex (PFC) and the hippocampus (HIP). It can be assessed using simple object exploration tasks.
In 2014, we demonstrated that six-month-old male 3xTg-AD mice exhibit deficits in the novel object recognition (NOR) task, along with alterations in β-amyloid aggregation and ERK1/2 signaling in the prefrontal cortex (PFC). In these animals, pharmacological inhibition of ERK1/2 overactivation reversed the memory deficits (Feld et al., 2014). However, three-month-old mice, which showed cytosolic overactivation in the PFC, did not display impairment in the NOR task.
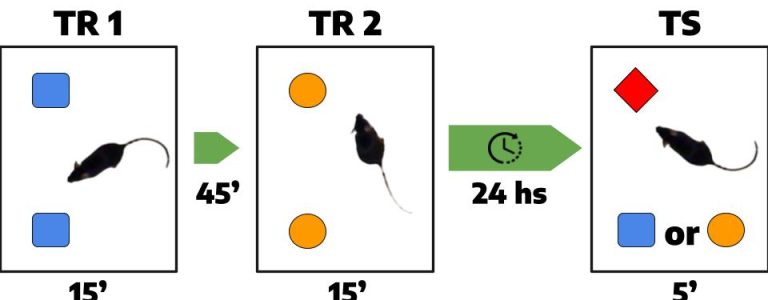
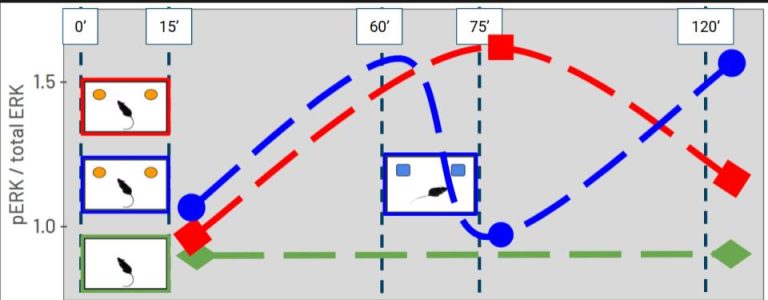
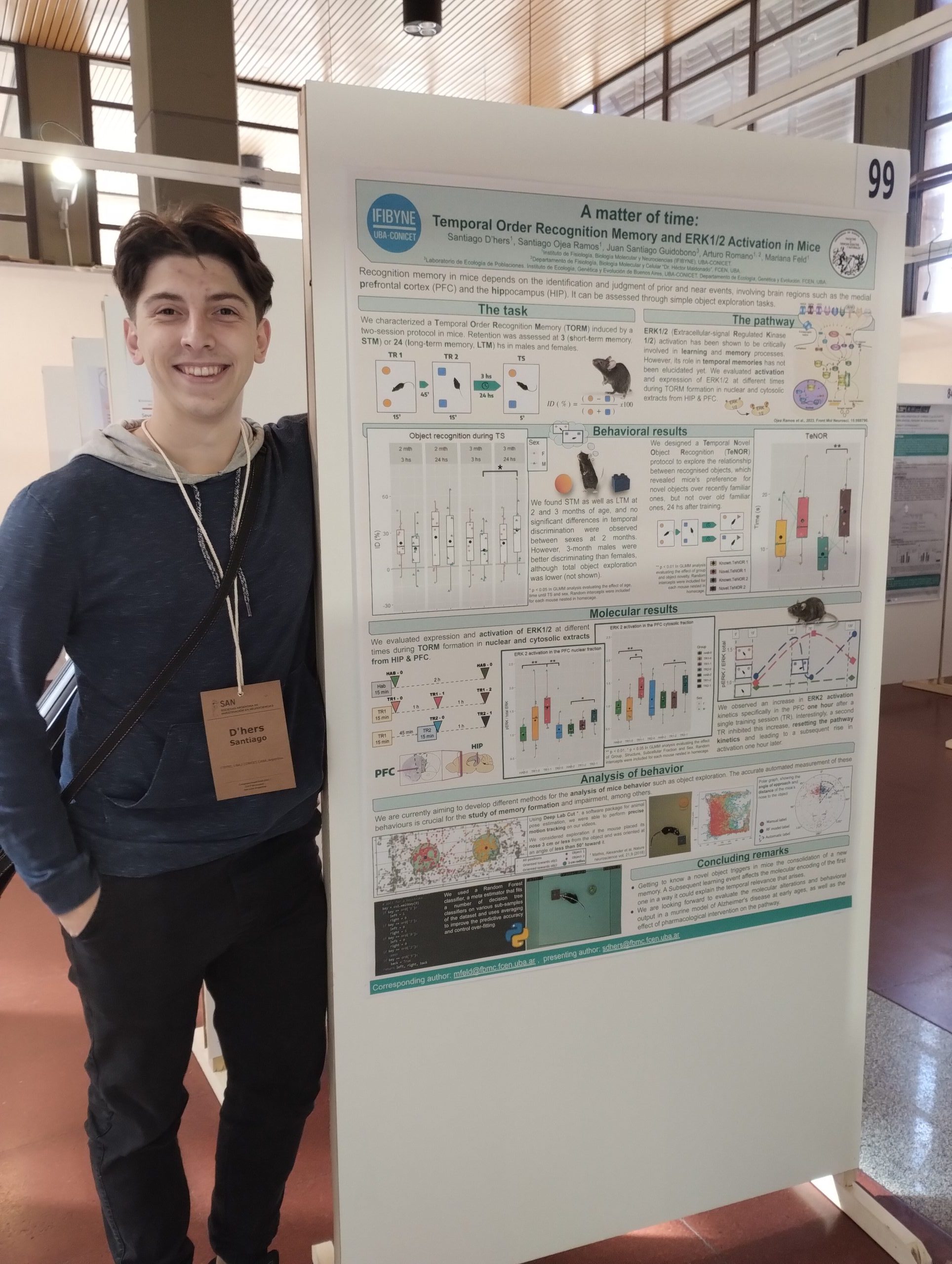
Currently, our study focuses on temporal order recognition memory (TORM), which depends on the PFC, using a two-session protocol (upper figure) and analyzing ERK1/2 activation (lower figure). We observed increased cytosolic and nuclear ERK2 activation specifically in the PFC one hour after a single training session (TR1). Interestingly, a second session (TR2) suppressed this increase, resetting the pathway kinetics and leading to a subsequent rise in activation one hour later.
Additionally, we developed a Temporal Novel Object Recognition (TeNOR) protocol to examine the temporal relationship between recognized objects. This paradigm revealed a preference for novel objects over recently familiar ones, but not over older familiar objects. These results warrant further investigation —including potential interventions— to elucidate the contribution of ERK2 to temporal memory formation and its implications for cognitive function.
 Exploratory behavior in rodents is widely used to assess cognitive function. However, manual analysis is time-consuming and prone to bias. RAINSTORM (Real and Artificial Intelligence for Neuroscience — Simple Tracker for Object Recognition Memory) is a versatile tool developed in our laboratory to optimize the study of such behaviors. The system integrates manual behavioral scoring, geometric analysis, and AI-assisted labeling, providing reproducible, scalable, and efficient analysis methods.
Exploratory behavior in rodents is widely used to assess cognitive function. However, manual analysis is time-consuming and prone to bias. RAINSTORM (Real and Artificial Intelligence for Neuroscience — Simple Tracker for Object Recognition Memory) is a versatile tool developed in our laboratory to optimize the study of such behaviors. The system integrates manual behavioral scoring, geometric analysis, and AI-assisted labeling, providing reproducible, scalable, and efficient analysis methods.
RAINSTORM processes pose-estimation data —for example, generated with DeepLabCut— to automate precise quantification of object exploration, although it can be easily adapted to a variety of tasks. This approach allows a comprehensive evaluation of learning and memory effects in rodents, revealing aspects that were previously unnoticed. By standardizing and accelerating analysis, RAINSTORM significantly improves the reproducibility of results.
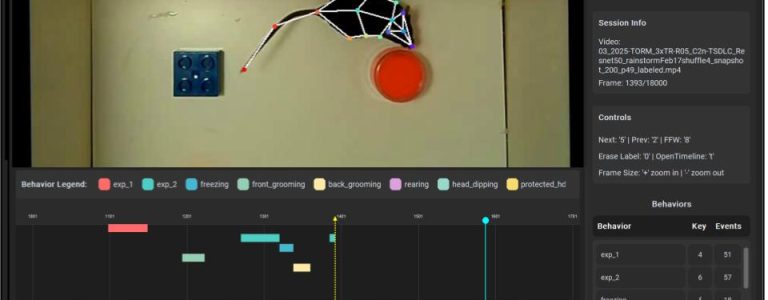
The tool was designed to learn from the labeling criteria of one or more experimenters, capturing different aspects of human expertise and reducing subjective bias in subsequent scoring procedures. In this way, the experimenter can transform raw pose-estimation data —coordinates of key body parts obtained using open-source software such as DeepLabCut— into precise exploration patterns within minutes.

Nuestros estudios muestran que la activación de ERK en el cerebro central del cangrejo es necesaria una hora luego del entrenamiento de 15 ensayos que induce la formación de una memoria contextual que dura aprox. 5 días. La inhibicion de la vía de ERK induce deterioro de la memoria de largo término (LTM), sin afectar la memoria de corto término.
Recientemente hemos desarrollado un protocolo de entrenamiento capaz de inducir la formación de una memoria contextual con solo dos ensayos espaciados por 45 minutos (2t-LTM, ver figura), que nos permite evaluar el aporte individual de cada uno a la estabilizacion de dicha memoria. Observamos que el primer ensayo induce la activación de la vía de ERK a los 30 minutos, y que el segundo desencadena una fosforilación más rápida en comparación con la primera (a los 5 minutos). La formación de la 2t-LTM depende de ambos eventos de activación, así como del tiempo transcurrido entre los ensayos, lo que permite plantear nuevas hipótesis acerca del papel de esta vía en la estabilización de LTMs (fig.).

Memoria y péptido βA en el cangrejo:
El péptido beta-amiloide (βA) se origina a partir del clivaje de la proteína precursora de βA (APP). El gen correspondiente en el cangrejo (cappl) muestra un 37 % de identidad con su homólogo en la mosca de la fruta (Drosophila melanogaster) y un 23 % con el de Homo sapiens, aunque presenta un grado mucho mayor de similitud de secuencia en regiones específicas. Además, el ARNm y la proteína cAPPL se encuentran ampliamente distribuidos en el sistema nervioso central del cangrejo, tanto en áreas cerebrales asociativas como sensoriales, y el curso temporal de su expresión sugiere un papel de cAPPL durante la formación de la memoria de largo término (LTM) (Fustiñana et al., 2010).
De manera consistente, nuestros estudios mostraron que bajas dosis de agregados de βA impiden la formación de memoria contextual en el cangrejo, y que este efecto estaría mediado, al menos en parte, por la activación de la vía ERK/MAPK, interfiriendo con la codificación necesaria para la consolidación de la LTM (Feld et al., 2008). Estos hallazgos sugieren una regulación fina de la vía ERK/MAPK, la cual se vería desbalanceada por la administración de agregados de βA. No obstante, es necesario caracterizar con mayor detalle este efecto, así como identificar las áreas del sistema nervioso involucradas en dichos procesos en Neohelice.
En colaboración con el Dr. Mariano M. Boccia (Laboratorio de Neurofarmacología de Procesos de Memoria, FFyB, UBA), caracterizamos tres períodos de activación de ERK1/2 tras la reactivación de una memoria consolidada de evitación inhibitoria (EI), los cuales permiten distinguir entre memorias fuertes y débiles, y resultan relevantes para tres fases diferenciadas del proceso de memoria (ver Fig.). La inhibición farmacológica de esta vía en el hipocampo dorsal de ratones interfiere con su reestabilización (cuando se aplica inmediatamente después de la reactivación), con su fortalecimiento (cuando se aplica 40 minutos después) o con su persistencia (cuando se aplica 180 minutos después).
Recientemente, hemos demostrado que un mecanismo poco estudiado (la dimerizacion de ERK) agrega una capa de regulacion al proceso de fortalecimiento/debilitamiento de la memoria que se observa luego de la labilizacion inducida por reactivación de la memoria de EI.
El péptido beta-amiloide (βA) constituye el principal componente de las placas neuríticas observadas en biopsias post mortem de cerebros de pacientes con enfermedad de Alzheimer (EA), la cual se caracteriza clínicamente en sus etapas iniciales por dificultades cognitivas y pérdida progresiva de la memoria, que se vuelven cada vez más severas e incapacitantes en los estadios avanzados. En contraste con el gran esfuerzo de investigación destinado al estudio de la neurotoxicidad y la neurodegeneración causadas por la acumulación crónica de estos péptidos, se ha explorado relativamente poco su posible rol fisiológico.
El βA puede unirse in vitro con alta afinidad a los receptores nicotínicos de acetilcolina (nAChR) e inducir la activación de diversas vías de señalización implicadas en la formación de la memoria, como las de ERK/MAPK y NF-κB, entre otras. Estos efectos dependen, por ejemplo, del tipo de péptido utilizado (p. ej., βA₁₋₄₀ o βA₁₋₄₂), su concentración, el tipo de exposición (crónica o aguda) y su estado de agregación. Sin embargo, la relación entre los efectos mnésicos del βA y las alteraciones en la señalización mediadas por dichas vías en paradigmas de memoria in vivo aún no ha sido estudiada en detalle.
En este contexto, abordamos el estudio de los mecanismos moleculares de la memoria en modelos murinos de EA que reproducen con alta fidelidad el desarrollo de la patología humana (Oddo et al., 2003). En estos trabajos, logramos caracterizar un deterioro temprano de la memoria en la tarea de reconocimiento de objetos novedosos, lo que sugiere una sutil desregulación de la función fisiológica del péptido βA en el hipocampo y la corteza prefrontal. Asimismo, observamos niveles elevados de activación de ERK1/2 en la corteza prefrontal —en su fracción citosólica a los 3 meses y nuclear a los 6 meses—, sin detectarse alteraciones en otras vías de señalización (p. ej., JNK, NF-κB y calcineurina). En este modelo, la administración intra-PFC de un inhibidor de la vía logró revertir el deterioro de la memoria, lo que sugiere que las alteraciones observadas podrían contribuir, al menos en parte, al déficit mnésico, probablemente como consecuencia de una interferencia en la consolidación de la traza de memoria (Fig.).

Actualmente, nos encontramos caracterizando otro tipo de conductas en un modelo similar, pero con background genético puro y más controlado, para profundizar el conocimiento de las bases moleculares y celulares que subyacen a los procesos fisiológicos de memoria, y que se ven alterados en estadios tempranos de patologías neurodegenerativas, específicamente la Enfermedad de Alzheimer (EA).
Memoria de reconocimiento
La memoria de reconocimiento depende de la identificación y evaluación de eventos previos y temporalmente cercanos, e involucra regiones cerebrales como la corteza prefrontal medial (PFC) y el hipocampo (HIP). Puede evaluarse mediante tareas simples de exploración de objetos en roedores.
En 2014 demostramos que ratones machos 3xTg-AD de seis meses de edad presentan déficits en la tarea de reconocimiento de objetos novedosos (NOR), junto con alteraciones en los niveles de agregación de β-amiloide y en la señalización de ERK1/2 en la corteza prefrontal (CPF). En estos animales, la inhibición farmacológica de la sobreactivación de ERK1/2 revirtió los déficits de memoria (Feld et al., 2014). Sin embargo, ratones de tres meses, que mostraban sobreactivación citosólica en la CPF, no evidenciaron deterioro en la tarea de NOR.
Actualmente, nuestro estudio aborda la memoria de reconocimiento del orden temporal (TORM), dependiente de la CPF, mediante un protocolo de dos sesiones (figura superior), y analiza la activación de ERK1/2 (figura inferior). Observamos un aumento en la activación citosólica y nuclear de ERK2 específicamente en la PFC una hora después de una única sesión de entrenamiento (TR1). De manera interesante, una segunda sesión (TR2) suprimió este incremento, reiniciando la cinética de la vía y generando un nuevo aumento en la activación una hora más tarde.


Además, desarrollamos un protocolo de reconocimiento de objetos novedosos temporales (TeNOR) para estudiar la relación temporal entre los objetos reconocidos. Este paradigma reveló una preferencia de los ratones por los objetos nuevos frente a los recientemente familiares, pero no frente a los antiguos familiares. Estos resultados merecen una exploración más profunda —incluyendo posibles intervenciones— para dilucidar la contribución de ERK2 a la formación de la memoria temporal y sus implicaciones en las funciones cognitivas.
 El comportamiento exploratorio en roedores se utiliza ampliamente para evaluar la función cognitiva. Sin embargo, su análisis manual requiere mucho tiempo y es susceptible a sesgos. RAINSTORM (Real and Artificial Intelligence for Neuroscience — Simple Tracker for Object Recognition Memory) es una herramienta versátil desarrollada en nuestro laboratorio para optimizar el estudio de este tipo de comportamientos. El sistema integra la evaluación conductual manual, el análisis geométrico y el etiquetado asistido por inteligencia artificial, ofreciendo métodos de análisis reproducibles, escalables y eficientes.
El comportamiento exploratorio en roedores se utiliza ampliamente para evaluar la función cognitiva. Sin embargo, su análisis manual requiere mucho tiempo y es susceptible a sesgos. RAINSTORM (Real and Artificial Intelligence for Neuroscience — Simple Tracker for Object Recognition Memory) es una herramienta versátil desarrollada en nuestro laboratorio para optimizar el estudio de este tipo de comportamientos. El sistema integra la evaluación conductual manual, el análisis geométrico y el etiquetado asistido por inteligencia artificial, ofreciendo métodos de análisis reproducibles, escalables y eficientes.
RAINSTORM procesa datos de estimación de postura —por ejemplo, generados con DeepLabCut— para automatizar la cuantificación precisa de la exploración de objetos, aunque puede adaptarse fácilmente a muchas otras tareas. Este enfoque permite una evaluación integral de los efectos sobre el aprendizaje y la memoria en roedores, revelando aspectos que antes pasaban inadvertidos. Al estandarizar y acelerar el análisis, RAINSTORM mejora significativamente la reproducibilidad de los resultados.
La herramienta está diseñada para aprender de los criterios de etiquetado de uno o varios experimentadores, capturando distintos aspectos de la pericia humana y reduciendo el sesgo subjetivo en los procedimientos de puntuación posteriores. De este modo, el experimentador puede pasar de datos sin procesar de estimación de postura —coordenadas de las partes clave del cuerpo del animal obtenidas mediante software de código abierto como DeepLabCut— a patrones precisos de exploración en cuestión de minutos.

Además, RAINSTORM permite la cuantificación precisa del tiempo de exploración de objetos familiares y novedosos, pudiendo extenderse a una amplia variedad de comportamientos exploratorios y aplicarse fácilmente a otros diseños experimentales que dependen de la cuantificación de la exploración, como las pruebas de preferencia social o de separación de patrones de objetos, entre otras.










D’hers S, Robles AD, Ojea Ramos S, Bollini G, Feld M. (2025) RAINSTORM: Automated Analysis of Mouse Exploratory Behavior Using Artificial Neural Networks. Curr Protoc. 5(7): e70171. doi: 10.1002/cpz1.70171.
Romano A, Freudenthal R, Feld M. (2023) Molecular insights from the crab Neohelice memory model. Front Mol Neurosci. 16: 1214061. doi: 10.3389/fnmol.2023.1214061. eCollection 2023.
Ojea Ramos S, Feld M and Fustiñana MS. (2022) Contributions of extracellular-signal regulated kinase 1/2 activity to the memory trace. Front Mol Neurosci. 15:988790. doi: 10.3389/fnmol.2022.988790.
Ojea Ramos S, Andina M, Romano A and Feld M. (2021) Two spaced training trials induce associative ERK-dependent long term memory in Neohelice granulata. Behav Brain Res. 403:113132. doi: 10.1016/j.bbr.2021.113132. Epub 2021 Jan 21.1)
Feld, M., Medina, C., Romano A, Freudenthal R. (2020) Molecular Neurobiology of Memory in Neohelice. Book Chapter in Rodriguez E, Luppi T. (eds.), Neohelice granulata: a model species for biological studies on crustaceans. Cambridge Scholars Publishing. ISBN-13: 978-1-5275-5003-2. Pp 71-102.
Krawczyk MC, Millan J, Blake MG, Feld M and Boccia MM. (2019) Relevance of ERK1/2 Post-retrieval Participation on Memory Processes: Insights in Their Particular Role on Reconsolidation and Persistence of Memories. Front. Mol. Neurosci. 12:95. doi: 10.3389/fnmol.2019.0009.
Krawczyk MC, Navarro N, Blake MG, Romano A, Feld M*, Boccia MM*. (2016). Memory reconsolidation induced memory persistence: participation of late phase hippocampal ERK activation. Neurobiology of Learning and Memory, 133:79-88. *, authors contributed equally to this paper.
Krawczyk MC, Blake MG, Baratti CM, Romano A, Boccia MM*, Feld M*. (2015) Memory reconsolidation of an inhibitory avoidance task in mice involves cytosolic ERK2 bidirectional modulation. Neuroscience.294: 227-237. *, authors contributed equally to this paper.
Feld M, Krawczyk MC, Fustiñana M S, Blake MG, Baratti CM, Romano A, Boccia MM (2014). Decrease of ERK/MAPK overeactivation in prefrontal cortex reverses early memory deficit in a mouse model of Alzheimer´s disease. Journal of Alzheimer’s Disease, 40(1):69-82. doi: 10.3233/JAD-131076.1
Feld M., Galli C., Piccini A. and Romano A. (2008) Effect on memory of acute administration of naturally secreted fibrils and synthetic amyloid-beta peptides in an invertebrate model. Neurobiology of Learning and Memory, 89(4):407-418.
Romano, A., Locatelli, Freudenthal, R., Merlo, E. Feld, M., Lemos, D., Ariel P., Federman M.N. and Fustiñana M.S. (2006) Lessons from a crab: Molecular mechanisms in different memory phases of Chasmagnathus. Parte del número especial “Invertebrate Models for Memory Mechanisms” del Biological Bulletin 210(3): 280-288.
Feld M., Dimant B., Delorenzi A., Coso O. and Romano A. (2005) Extra-nuclear activation of ERK/MAPK is required for long-term memory consolidation in the crab Chasmagnathus. Behavioural Brain Research 158(2):251-261.
I am item content. Click edit button to change this text. Lorem ipsum dolor sit amet, consectetur adipiscing elit. Ut elit tellus, luctus nec ullamcorper mattis, pulvinar dapibus leo.
Integrantes del grupo

Santiago D´hers
Tesista doctoral

Santiago D´hers
Tesista doctoral
- Phone:+549 (11) 2546-6589
- Email:info@example.com

Mariana Cambiaso
Tesista doctoral

Mariana Cambiaso
Tesista doctoral
- Email:mariancambiaso@gmail.com

Guillermina Bollini
Tesista de grado

Guillermina Bollini
Tesista de grado
- Phone:+549 (11) 2546-6589
- Email:info@example.com

Charo Colina
Tesista de grado

Charo Colina
Tesista de grado
- Phone:+549 (11) 2546-6589
- Email:info@example.com

Florencia Gaita
Pasante - Estudiante de Física

Florencia Gaita
Pasante - Estudiante de Física
- Phone:+549 (11) 2546-6589
- Email:info@example.com

Julia Grebe
Pasante - Estudiante de Física

Julia Grebe
Pasante - Estudiante de Física
- Phone:+549 (11) 2546-6589
- Email:info@example.com
Miembros Anteriores
Debora Intile Borona



